Autoimmundiagnostik
Der Fachbereich Autoimmundiagnostik ist aus mehreren Einzellaboren von Charité und Vivantes hervorgegangen.
Die Dienstleistungen der Autoimmundiagnostik umfassen heute
- die gesamte Labordiagnostik von Patienten mit Autoimmunerkrankungen mittels modernster Labor- und Immundiagnostik,
- die Unterstützung von öffentlich geförderten Drittmittelprojekten und
- die Mitarbeit in von der Industrie gesponserten sowie Investigator-initiierten Studien.
-
Zurzeit bestimmt die Autoimmundiagnostik rund 140 Parameter mittels folgender Methoden:
- Immunfluoreszenz
- ELISA
- Immunoblot
- PCR
- Mikroarray
Die Ausstattung umfasst alle Geräte, die zur Parameterbestimmung nötig sind, zum Beispiel:
- Immunfluoreszenz-Mikroskopie (IF)
- Automatische Vorbereitung von Objektträgern zur IF-Mikroskopie
- Aklides (zur elektronischen Auswertung von IF-Slides)
- Mikrotiterplatten-Reader
- Laborautomaten
- ELISA
- Blot-Master
- Blot-Scanner
- PCR-Cycler
- Microarray-Scanner
-
Interpretation der Messergebnisse
Das Prinzip immunologischer Nachweistechniken, die im Bereich Autoimmundiagnostik eingesetzt werden, ist die Antigen-Antikörperreaktion bei der Antigen (Ag) und Antikörper (Ak) eine spezifische, reversible Bindung eingehen. Zu den Methoden, die aktuell in der Autoimmundiagnostik eingesetzt werden, gehören indirekte Immunfluoreszenz (IIFT), Enzyme-linked Immunoassay (EIA) und Immunoblotting/Line Immunoassay (LIA).
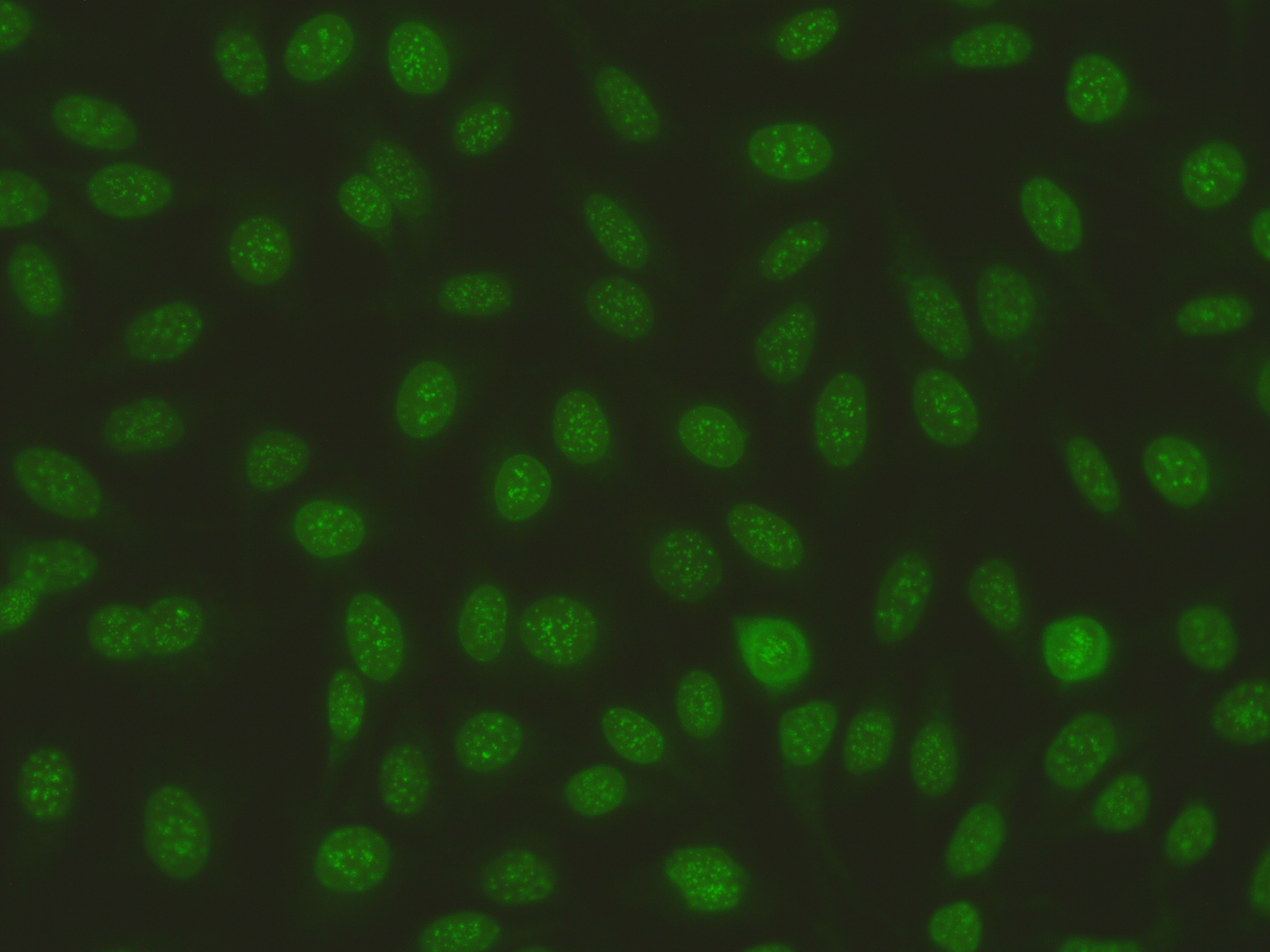
Indirekte Immunfluoreszenz auf HEp-2-Zellen (HEp-2 IFT)
(Bisher: Antinukleäre Autoantikörper, ANA)
Die Bestimmung von Autoantikörpern mittels indirekter Immunfluoreszenz (IFT) ist ein essentieller Bestandteil der Diagnostik und Klassifikation etlicher Autoimmunerkrankungen. Abgesehen von der qualitativen Aussage „negativ“ oder „positiv“ liefert diese Untersuchung noch weitere wertvolle Informationen. Neben der Intensität der Reaktion, die verursacht wird durch die Menge der vorhandenen Antikörper und als Titer dargestellt wird, können die Autoantikörper vielfältige Fluoreszenzmuster verursachen, die sich auf den Nukleus, das Zytoplasma und die Mitosestadien der untersuchten Zellen beziehen.
Als Substrat für das Screening auf organunspezifische Autoantikörper werden HEp-2-Zellen eingesetzt. Die Untersuchungsergebnisse können manchmal variieren, sowohl zwischen einzelnen Mitarbeitern eines Labors als auch zwischen unterschiedlichen Laboratorien. Die Ursachen für diese Abweichungen können objektiv, z. B. unterschiedliche Reagenzien, oder subjektiv, durch unterschiedliche Erfahrungswerte, sein.
Die Initiative „ICAP“ (Internationaler Konsens für antinukleäre Antikörper (ANA)-Muster/International Consensus on Antinuclear Antibody Pattern) wurde gegründet mit der Zielsetzung, eine einheitliche Nomenklatur bezüglich verschiedener Fluoreszenzmuster zu finden, welche mit der indirekten Immunfluoreszenztechnik auf HEp-2 Zellen erkannt und beschrieben werden können. Da in diesem Klassifikationssystem nukleäre, mitotische und zytoplasmatische Antikörper beinhaltet sind, wird für den Screening-Test die Bezeichnung „HEp-2-Zellen IFT“ empfohlen.
Unter dem folgenden Link stehen weitere detaillierte Informationen zu der Klassifikation und Nomenklatur zur Verfügung:
Die klinische Relevanz der nachgewiesenen Autoantikörper sollte immer im Zusammenhang mit der klinischen Verdachtsdiagnose beurteilt und in der Regel durch eine weitere Methode bestätigt bzw. ergänzt werden.
Literatur:
E.K.L. Chan, J. Damoiseaux, O.G. Carballo, K. Conrad, W. de Melo Cruvinel, P.L.C. Francescantonio, M.J. Fritzler, I. Garcia-De La Torre, M. Herold, T. Mimori, M. Satoh, C.A. von Mühlen, and L.E.C. Andrade. Report of the First International Consensus on Standardized Nomenclature of Antinuclear Antibody HEp-2 Cell Patterns (ICAP) 2014-2015 (Front. Immunol. 2015, Aug 20;6:412).
Enzyme-linked Immunoassay (EIA)
Meistens sensitiver als die IIFT, was mit einem Verlust an Spezifität verbunden sein kann. Ergebnisse können von denen, die mit einer anderen Methode bestimmt wurden, abweichen. Die Bedeutung der unterschiedlichen Methoden und deren Ergebnisse muss immer mit dem klinischen Bild des Patienten beurteilt werden, da die Struktur bzw. Präsentation des Antigens je nach Methode so wie der zeitliche Verlauf und Höhe von Antikörpern, bzw. deren Abfall und Anstieg, individuell variieren kann.
Immunoblotting, Line Immunoassay (LIA)
Diese Methode kann hilfreich sein, wenn mehrere Antikörper gleichzeitig wie z. B. onkoneuronale Antikörper nachgewiesen werden sollen. Die Ergebnisse, die mit dieser Methode erzielt werden, sind quantitativ ggf. semiquantitativ:
– negativ(+) fraglich/grenzwertig
+ schwach positiv
++ positiv
+++ stark positiv
Prinzipiell bedeutet eine höhere Sensitivität der Laboruntersuchungen auch eine höhere diagnostische Sensitivität, gleichzeitig aber auch eine niedrigere Spezifität. Bei der Bewertung muss berücksichtigt werden, dass aktuell keine Goldstandard-Methode in diesem Bereich der Diagnostik existiert. Die fehlende Standardisierung der Methoden kann unterschiedliche Ergebnisse in verschiedenen Laboratorien und große Unterschiede bei der Durchführung externer Qualitätskontrollen (Ringversuche) verursachen. Darüber hinaus sind die einzelnen Methoden in der Aussagekraft nicht vergleichbar.
Für die Verlaufsbeurteilung ist die kritische Differenz, die von der Präzision der Methode (Standartabweichung, SD) abhängig ist, von großer Bedeutung. Der Unterschied zwischen zwei Bestimmungen kann als statistisch signifikant bezeichnet werden, wenn sich zwei Messergebnisse um mindestens +3SD unterscheiden.
Zusammengefasst ist für die Diagnose der Einsatz verschiedener Methoden, die sich ergänzen können, erforderlich. Eine effektive und erfolgreiche Diagnostik kann nur mit Hilfe einer Verknüpfung zwischen Patienten, Arzt und Labor erreicht werden, wobei die klinische Manifestation der Erkrankung eine wesentliche Rolle in der Interpretation der Laborergebnisse spielt.
Literatur:
K. Dörner: Klinische Chemie und Hämatologie, 2009
A. Hall et al.: Clinical Immunology, Fundamental of Biomedical Science, 2016
B. Neumeister, B. O. Böhm: Klinikleitfaden: Labordiagnostik, 2015
K. M. Pollard: Autoantibodies and Autoimmunity, 2006
G. Spickett: Oxford Handbook of Clinical Immunology and allergy, 2020Kontakt: autoimmundiagnostik@laborberlin.com
-
Eingebunden in die Forschung
Der Fachbereich Autoimmundiagnostik ist an zahlreichen Forschungsvorhaben im Klinik- und Industriesektor beteiligt. Im Rahmen dieser Projekte sind neue wichtige Assays zur Autoantikörper-Bestimmung entstanden, so etwa:
- Anti-MCV-ELISA
- POCT-Assay RheumaChec
- Anti-dsDNA-ELISA
- Anti-PR3-hn-hr-ELISA
- Epitopmapping zur Therapieüberwachung von Biologicals bei der Rheumatoide Arthritis (RA)
Bei der nationalen Multizenterstudie Hit-Hard, die von der Medizinischen Klinik mit Schwerpunkt Rheumatologie und Klinische Immunologie ins Leben gerufen wurde, das Referenzlabor. Außerdem ist das Labor Bestandteil von zwei Forschungsverbund–Projekten und leistet Beträge im Rahmen zahlreicher Therapie-Studien.
Anforderungsscheine
Leistungen für Privatpatienten, selbstzahlende Patienten oder laborärztliche Wahlleistungen werden durch LABOR BERLIN direkt mit dem betreffenden Kostenträger abgerechnet, sofern mit dem Einsender nicht etwas anderes vereinbart ist. Hierzu wird der Einsender die notwendigen Daten der Patienten an LABOR BERLIN weiterleiten und sicherstellen, dass die Patienten über die mögliche Weiterleitung von Laboraufträgen an LABOR BERLIN und die damit verbundenen organisatorischen Maßnahmen, einschließlich der Abrechnung durch eine privatärztliche Verrechnungsstelle, in der gesetzlich vorgeschriebenen Weise informiert werden und hierin einwilligen. Die rechtlichen Vorgaben in Bezug auf die freie Arztwahl werden dabei berücksichtigt. Wir weisen darauf hin, dass die Veranlassung externer laborärztlicher Wahlleistungen nach den Regelungen des Krankenhausentgeltgesetzes (KHEntgG) durch den Einsender einzelfallbezogen und konkret durch die betreffenden Wahlärzte zu erfolgen hat.
-
Anforderungsschein Autoimmundiagnostik
pdf





